MINFLUX 3D
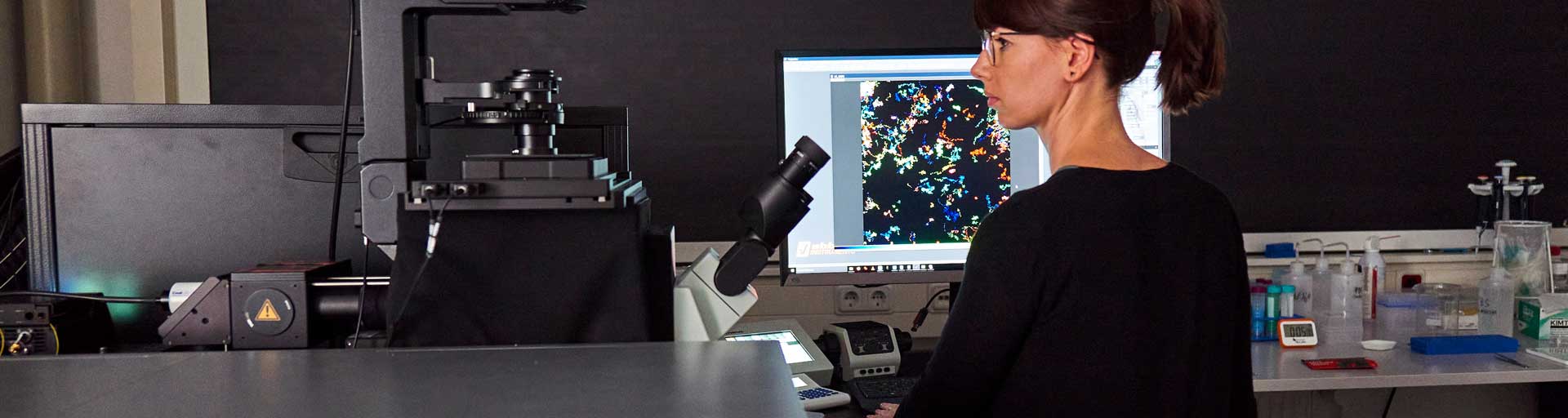
MINFLUX 平台优秀的成像能力,使您可分辨分子尺度的三维结构。这种分子尺度的分辨率以及极快的速度可显示更多的细节。MINFLUX 目前是分辨率最好的荧光显微镜之一。
这种单子分子纳米尺度的分辨率以及超乎寻常的速度可揭示从未看见过的细节。MINFLUX 是世界上最强大的荧光显微镜之一。
优秀的分辨率和速度
说明
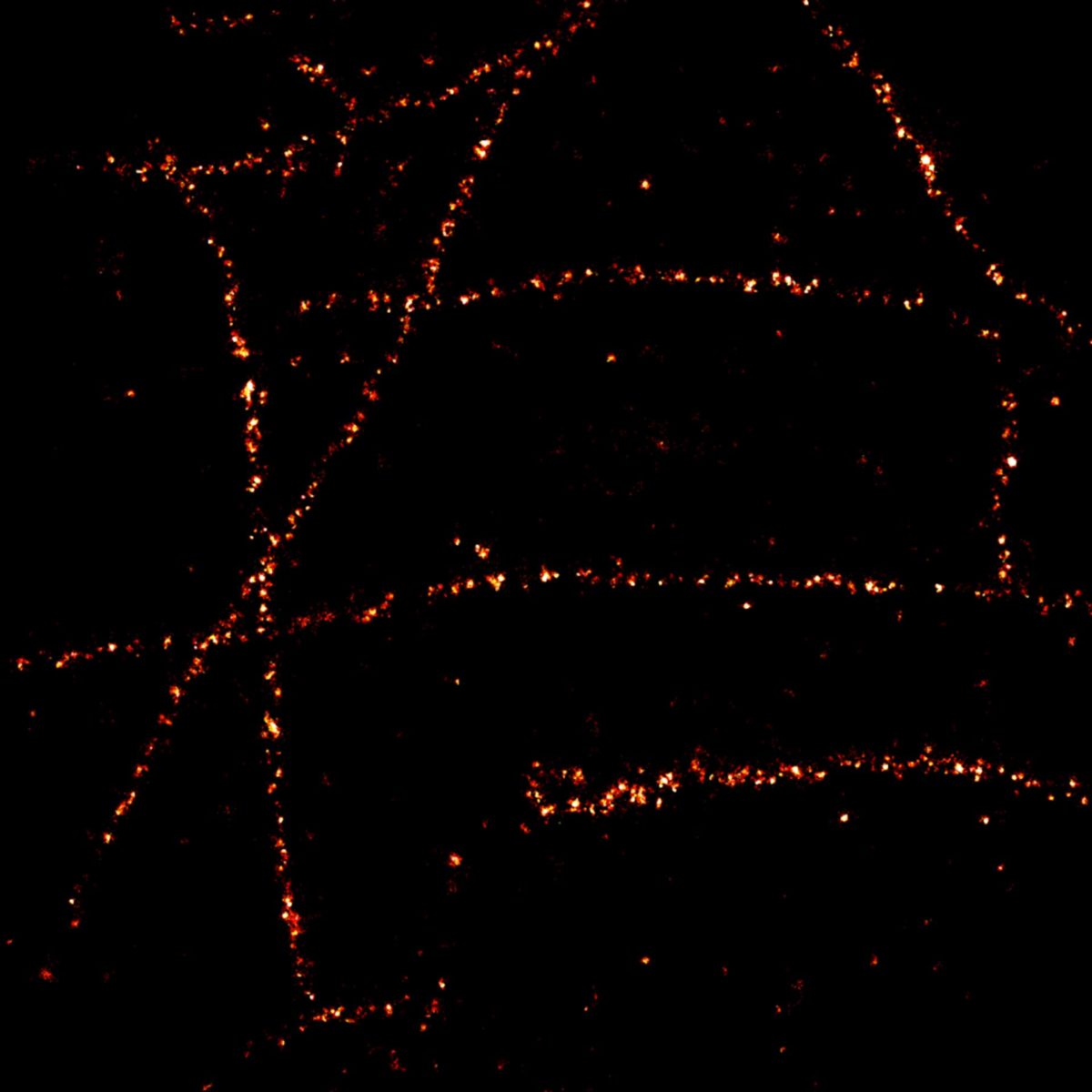
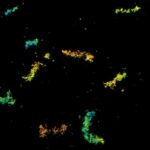
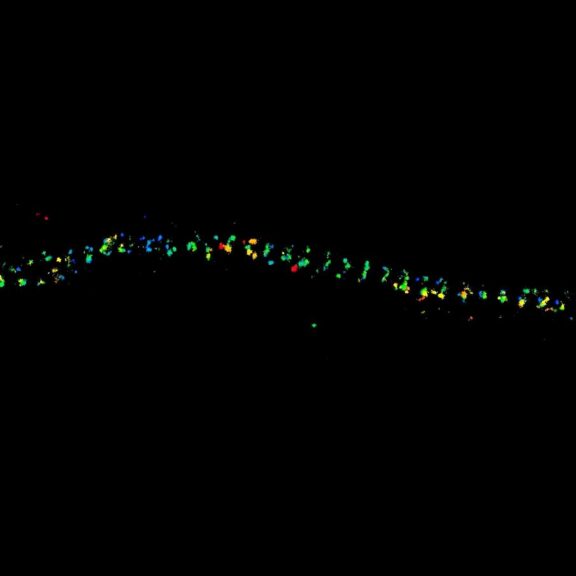
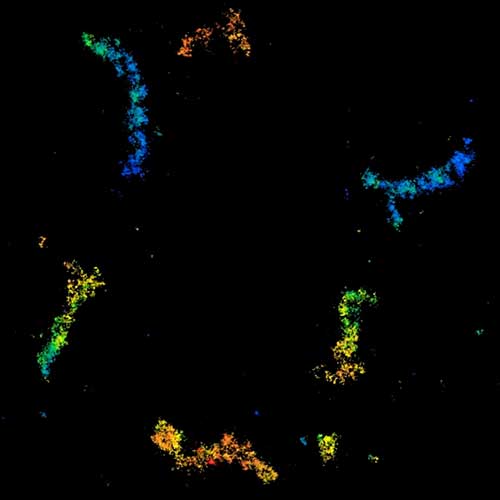
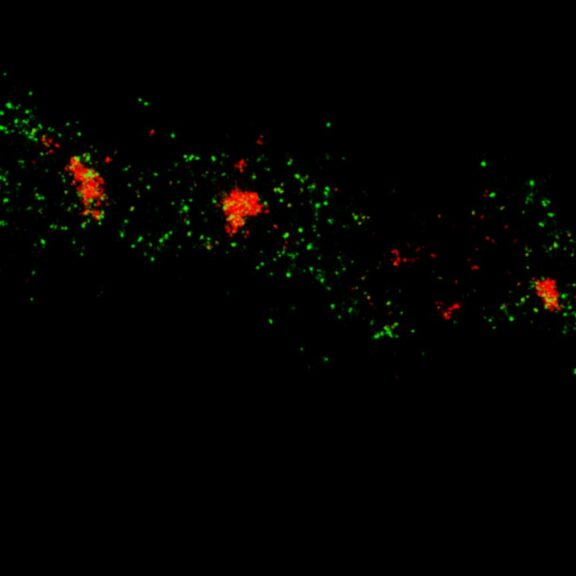
MINFLUX 3D 成像,原代培养海马神经元中 βII 血影蛋白,用 Alexa Fluor 647 进行免疫荧光标记。轴向坐标以颜色代表。请注意血影蛋白在轴突中的周期性排布。
说明
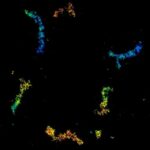
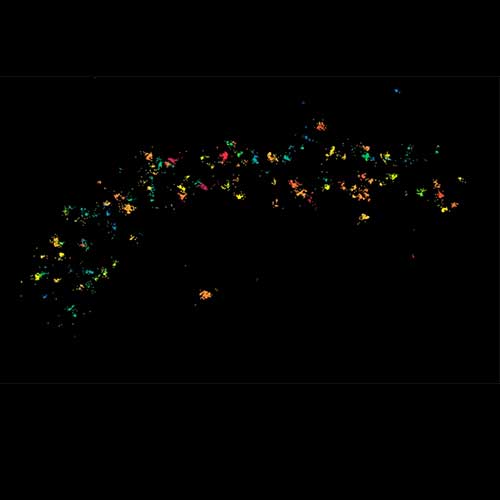
MINFLUX 对于网格蛋白包被囊泡和被膜小窝的 3D 成像 样品通过网格蛋白轻链 -SNAP 和 SNAP-Alexa Fluor 647 标记。
说明
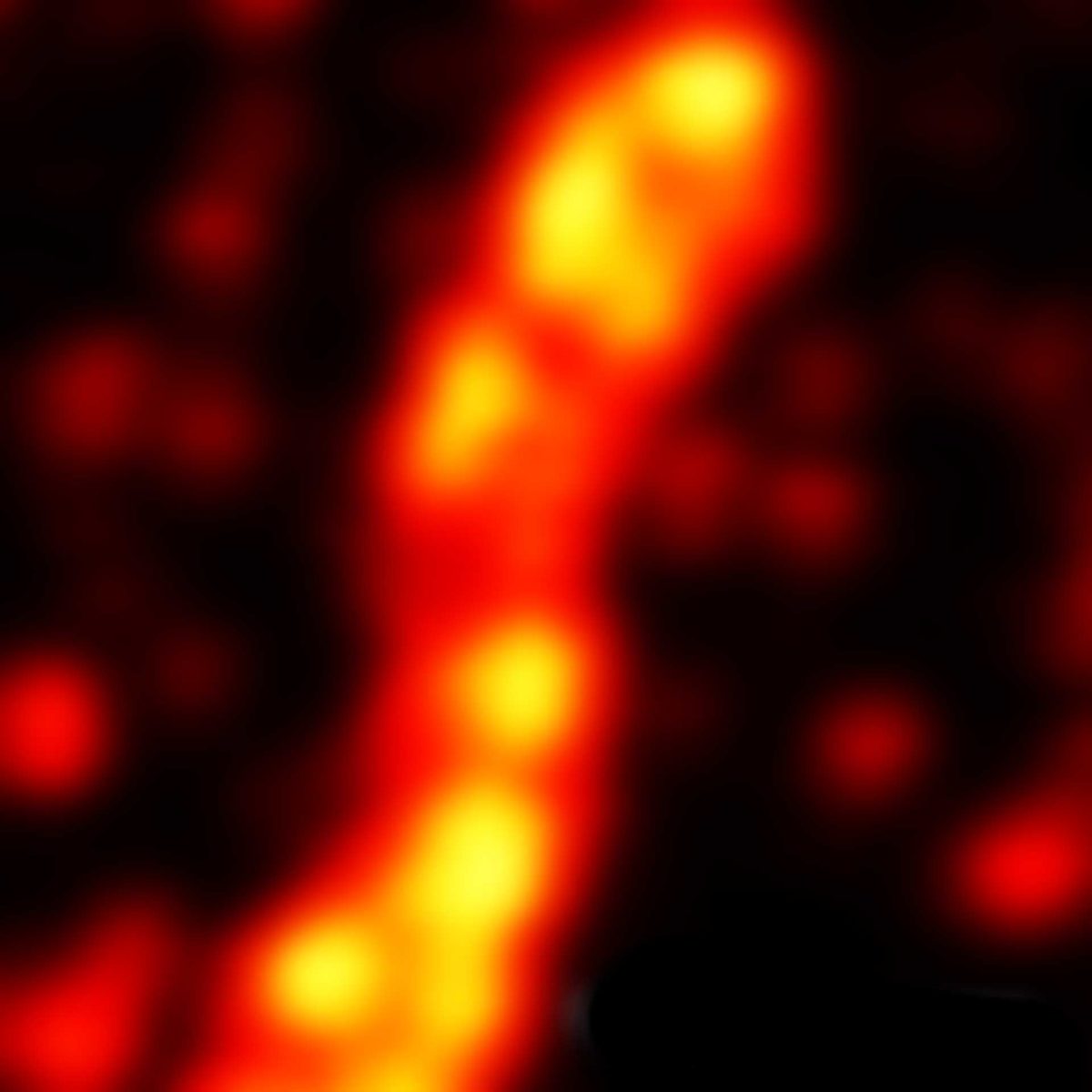
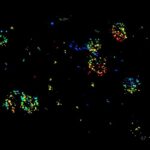
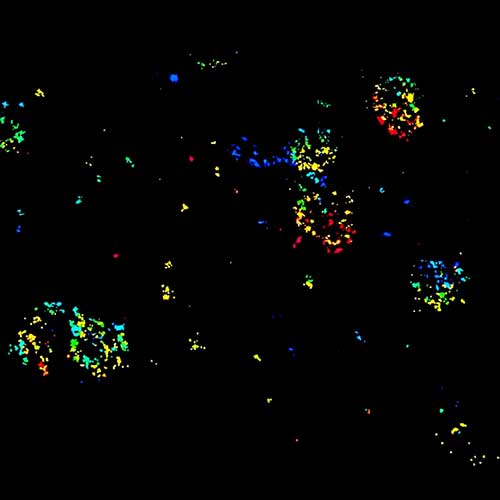
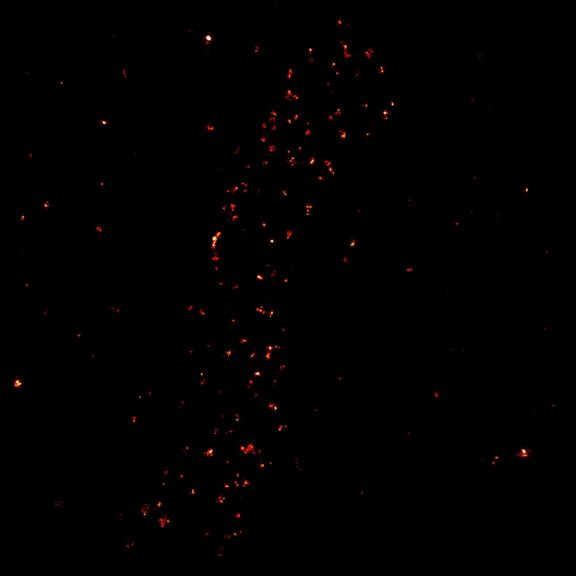
MINFLUX 对于固定哺乳动物细胞中过氧化物酶体膜蛋白 PMP70 的成像,使用 Alexa Fluor 647 进行免疫荧光标记。MINFLUX 3D 使得在各个方向上呈现过氧化物酶体的形态成为可能。
说明
3D MINFLUX 可以呈现出过氧化物酶体的整个形态.
说明
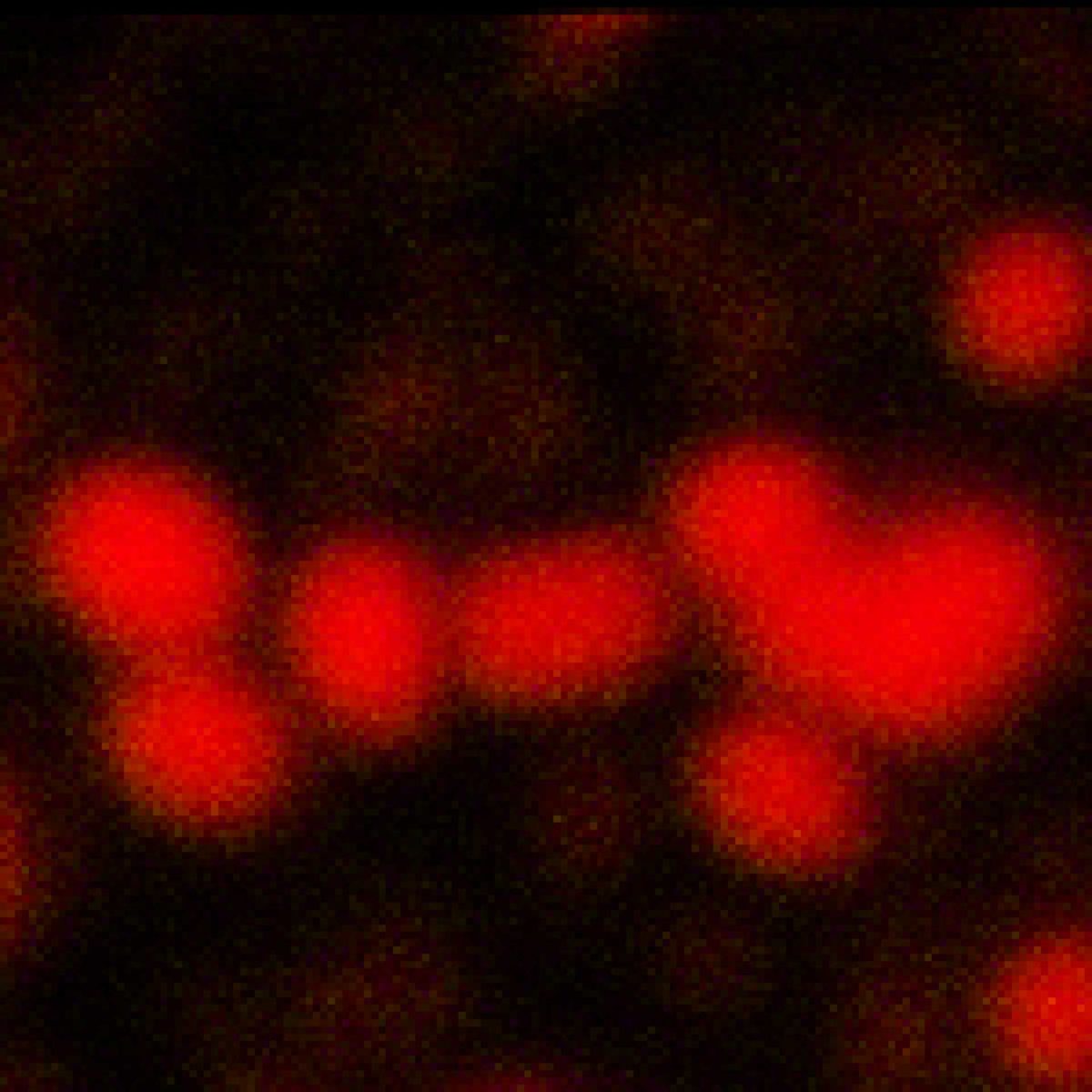
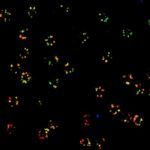
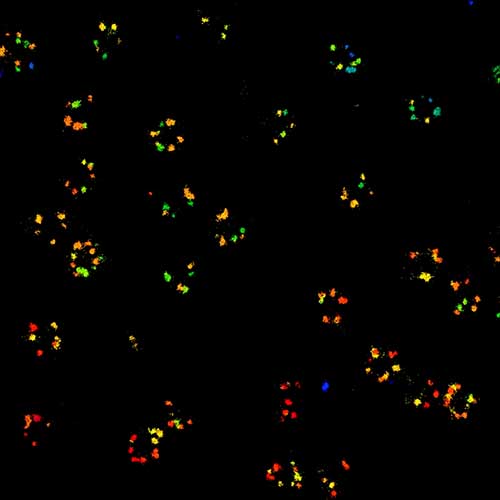
MINFLUX 3D 纳米显微镜展示核孔复合物亚基 3D MINFLUX 促进分子尺度的 3D 成像 在轴向的定位中,我们的原始数据达到了约 2.5 nm 的定位精度 NUP96-SNAP 是通过 SNAP-Alexa Fluor 647 标记的
说明
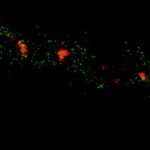
MINFLUX 对固定哺乳动物细胞线粒体输入受体蛋白 Tom20 的成像,使用 Alexa Fluor 647 进行免疫标记。请注意 Tom20 蛋白只定位在线粒体表面。
说明
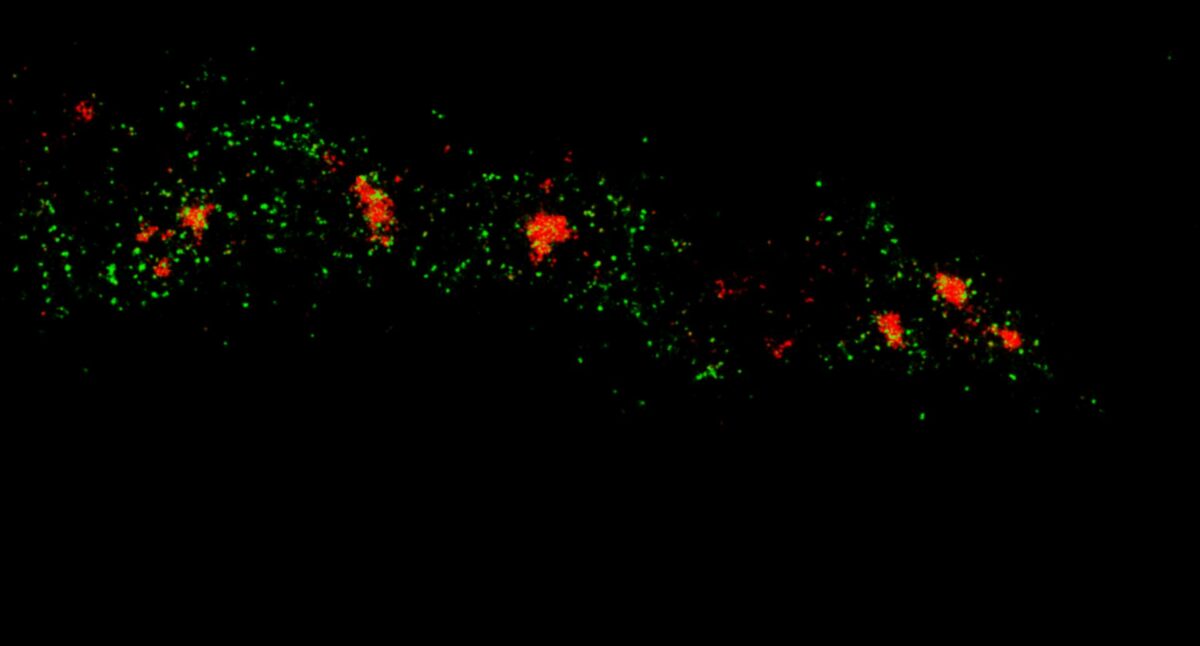
线粒体双色 MINFLUX 成像。哺乳动物细胞中线粒体蛋白 TOM20 (绿色) 和 mtDNA (红色) 分别用偶联 sCy5 和 CF680 的二抗进行免疫荧光标记。双色共聚焦 (A) 和 MINFLUX (B) 使用了比例探测的策略来进行双色成像。请注意两种结构的标记密度差异很大。线粒体膜中的单个 TOM20 蛋白被标记,而 mtDNA 中许多个结合位点被标记了。MINFLUX 可以区分并呈现两种不同的结构。
说明
核孔复合物亚基的 2D MINFLUX 纳米成像。作为测试超分辨率光学显微镜的基准测试结构 NUP96-SNAP/SNAP-Alexa Fluor 647。不同于共聚焦成像, 2D MINFLUX 可以直观的呈现单个核孔复合物亚基的形态和排布。在此,我们从分子定位的原始数据中获得了约 2 nm 的定位精度。
说明
原代海马神经元轴突血影蛋白 bII 的 MINFLUX 图像,分辨率 < 2 nm。注意,血影蛋白沿轴突呈周期性排列,对应的共聚焦图像无法呈现任何细节。
说明
过氧化物酶体膜蛋白 PMP70 的 2D MINFLUX 成像。在固定哺乳动物细胞中,PMP70 用 Alexa Fluor 647 进行免疫荧光标记。
说明
线粒体外膜易位酶 TOM20 的 2D MINFLUX 成像。在固定哺乳动物细胞中,TOM20 用 Alexa Fluor 647 进行免疫荧光标记。
说明
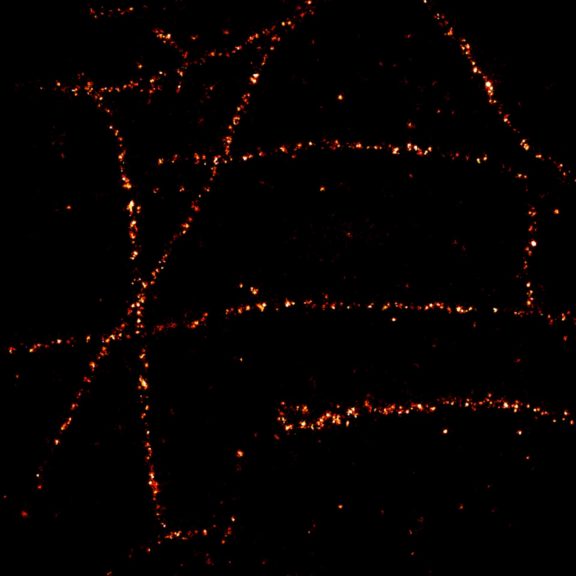
细胞骨架波形蛋白的 2D MINFLUX 成像。在固定哺乳动物细胞中,波形蛋白用 Alexa Fluor 647 进行免疫荧光标记。注意共聚焦图像不能分辨交叉处的单个波形蛋白。
说明
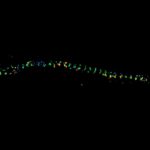
在脂质双层中 2D 追踪偶联 Atto 647N 染料的单个脂质分子。标记脂质分子的运动以 10 kHz 的频率被追踪。
清晰度
比共聚焦显微镜高 100 倍
虽然以前的超高分辨率方法影响力很大,但未能实现单个荧光分子尺度的分辨率。MINFLUX 基于全新和革命性的定位原理,最终实现了该目标。十倍于传统超高分辨,百倍于共聚焦荧光成像的跨越,
MINFLUX 是精确和超高光子效率的荧光分子定位方式。通过新型 MINFLUX 系统,abberior 制造出第一款可在生物样品中实现大视场 (10 x 15 μm) 和1-3 nm (3D) 空间分辨率的商用荧光显微镜。MINFLUX 成像意味着可从样品中掘取最多的定位信息。
追踪速度
比相机快 100 倍
MINFLUX 可以高达 10 kHz 的频率追踪分子,即以 100 µs 间隔解析分子运动。这比普通基于相机的追踪快 100 倍。当然,追踪在所有三个方向即沿 x、y 和 z 轴进行。由于每次定位只需要少量光子,因此能以空前的高时空分辨率监测单个分子(以 20 nm 分辨率进行 28,000 次定位)。
MINFLUX 是最快的定位荧光分子的方式之一。通过其革命性的 MINFLUX 显微镜,abberior 以全球最高的时间分辨率在分子追踪方面达到了一个新水平,为各学科的生命科学家开启了崭新的大门。
一键式切换 MINFLUX 分子成像与分子追踪!


使用 sCy5 和 CF680 进行间接免疫标记染色的哺乳动物细胞中的 Tom20 (绿)和线粒体 DNA (红)双色共聚焦和 MINFLUX 图像。两种荧光团由比率检测法区分。注意两个成像结构的不同标记密度。
最大化分辨率
来自于最低荧光发射

MINFLUX 定义了一种全新的超高分辨方法,充分利用了 STED 显微镜和单分子定位技术的优点: 1) 单一时间只激活单个荧光发射,以获得最佳分子区分效果, 2) 荧光发射的光分布采用中心零强度(而非最大强度)法以执行定位。这从根本上减少了实现精确定位所需的发射光子数量。激发光束的中心零强度法通过执行亚纳米探测步骤搜索发射分子。零强度点离分子越近,所产生的荧光度越低。通过优化实现低发射速度,MINFLUX 显微镜将放大分子,从而提高所显示的分子位置精度。
将激发光束的暗影中心与分子位置匹配,最大限度地减少荧光通量,可靠地定位分子,3D 精度达单分子纳米级别! 通过发射最小化而不是最大化,MINFLUX 定位有如下特点: i) 与生俱来的快速, ii) 不丢弃弱发射的分子, iii) 最大程度地减少了漂白,并且 iv) 对漂移的依赖性更小。未知分子取向和翻振对相机质心定位精确性产生的严重影响被排除。
标准镜体
有如日常工作
Abberior 的科学家和研发人员深知平稳和简便的操作对于生物学研究至关重要。我们 MINFLUX 系统采用了标准显微镜镜体,可提供从各种不同的选项,包括宽场荧光显微镜、DIC 显微镜、相差显微镜、共聚焦和 STED 显微镜、直至 MINFLUX。为了最大程度地提高耐久性,我们制造 MINFLUX 系统时在坚固的光学台面上采用可靠的,久经时间考验的元件来组装。我们使用异常坚固的光机模块,这些模块已在全球数百台 abberior 显微镜中被证实能高效稳定地工作。
另外,按照我们尖端仪器的设计理念,我们的 MINFLUX 系统具有前瞻性,其设计可适用最新技术:永久保持高性能。
几乎无漂移
稳如磐石
进行纳米分辨率的实验时,极微小的样品漂移和移动就能影响性能。因此,我们的 MINFLUX 采用了主动亚纳米稳定技术。MINFLUX 成像时,基于激光照明基准标记的全自动稳定系统使样品保持完美静止,三维上残留的波动 < 1 nm。
- 线频高于 100 kHz:扫描速度比任何其他方法快 100 倍
- 单分子纳米定位精度:分辨率比共聚焦显微镜高 100 倍
- 每 100 µs 定位一次:追踪荧光分子比相机快 100 倍